Опис завдання
Ця вправа допоможе тобі швидко перевірити, чи розумієш одну з базових ідей будови атома: як називається область найбільш ймовірного знаходження електрона. У завданні потрібно прочитати запитання та вибрати правильний варіант із кількох відповідей. Такий формат дуже схожий на тестові питання ЗНО з хімії, тому тренування буде корисним і для повторення, і для самоконтролю.
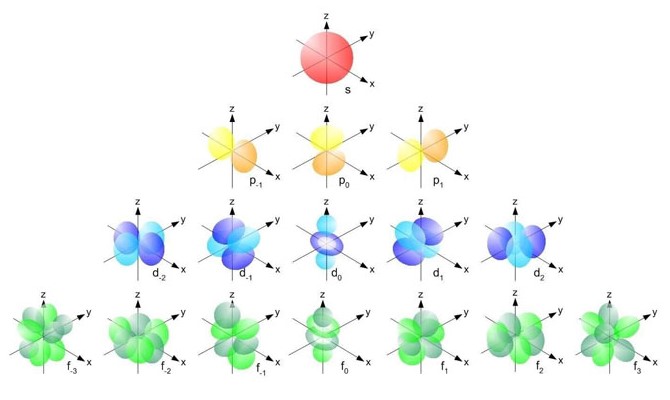
Ти побачиш варіанти відповіді на кшталт «ядро», «орбіталь», «траєкторія електрона», «орбіта електрона». Тут важливо не плутати поняття з різних моделей атома. У сучасному уявленні електрон не «літає по доріжці», як планета навколо Сонця. Натомість ми говоримо про область простору, де електрон найімовірніше може перебувати. Саме це формулювання часто зустрічається в тестах.
Для учня це коротка, але дуже точна перевірка знань термінів. Для батьків — зрозумілий спосіб побачити, що саме дитина вчить і де може помилятися. Для вчителів — зручний міні-інструмент для закріплення теми перед контрольними або підготовкою до ЗНО.
- Тренуєш уважне читання запитання та швидкий вибір правильної відповіді.
- Закріплюєш ключові терміни з теми будови атома.
- Вчишся розрізняти близькі за звучанням поняття та не плутати їх у тестах.
- Підходить для самостійної підготовки та повторення перед ЗНО з хімії.
Виконуй вправу кілька разів, щоб відповідь стала впевненою та автоматичною. Якщо помилився — не страшно: повернись до формулювання запитання й подумай, яке слово точно описує «область найбільш ймовірного знаходження електрона в атомі». Так ти не просто запам’ятаєш термін, а й зрозумієш його зміст.
Пов'язані стандарти
Учасник/учасниця ЗНО повинен/повинна вміти:
- записувати та розпізнавати електронні формули атомів і простих йонів елементів № 1—20 і 26 та їхні графічні варіанти, атомів неметалічних елементів малих періодів у основному і збудженому станах. Розрізняти валентність і ступінь окиснення елемента;
- складати формули сполук за ступенями окиснення елементів;
- порівнювати можливі ступені окиснення неметалічних елементів малих періодів, що знаходяться в одній групі, на основі електронної будови їхніх атомів; радіуси атомів і простих йонів;
- аналізувати зміни радіусів атомів у періодах і підгрупах, зв'язоккількості електронів на зовнішньому рівні з характером елемента (металічним, неметалічним), типом простої речовини (метал, неметал), кислотногосновним характером оксидів і гідроксидів, відмінності електронної будови атомів s-,p-, d-eлементів (Ферум) 1-4 періодів;
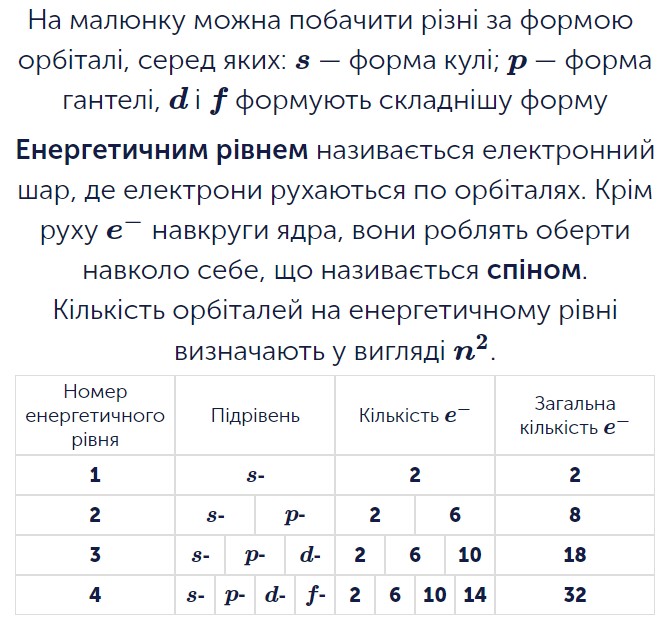
- визначати склад ядер (кількість протонів і нейтронів у нукліді) і електронних оболонок (енергетичних рівнів та підрівнів) в атомах елементів № 1—20 і 26, загальну кількість електронів і число електронів на зовнішньому енергетичному рівні атомів елементів № 1—20 і 26;
- обчислювати ступінь окиснення елемента у сполуці.