Опис завдання
У цій вправі ти потренуєшся розпізнавати, ким є Протій, Дейтерій та Тритій. На екрані є запитання з вибором однієї правильної відповіді та кілька варіантів: «ізомери», «ізохори», «ізобари», «ізотопи». Завдання допомагає швидко пригадати важливі поняття з теми «Склад атома. Нуклонне число» та закріпити базову термінологію, яка часто трапляється в тестах ЗНО з хімії.
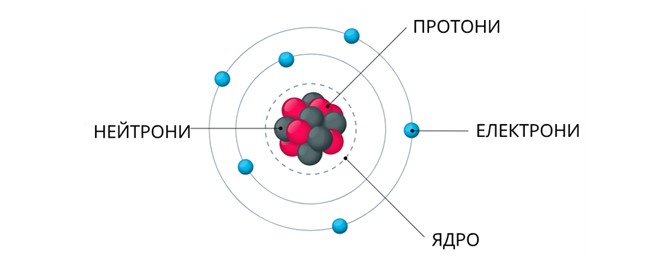
Протій, Дейтерій і Тритій пов’язані з одним і тим самим хімічним елементом, але відрізняються складом ядра. Саме тому під час підготовки до ЗНО важливо не плутати схожі слова: ізотопи, ізобари, ізомери та інші «ізо-» терміни. Ця вправа вчить уважно читати запитання, порівнювати варіанти та обирати правильне визначення без зайвих сумнівів.
Виконуй завдання так: прочитай формулювання, пригадай, що означає кожен термін, і вибери один варіант. Після відповіді ти одразу бачиш результат і можеш повторити спробу, щоб закріпити знання. Це зручно і для самостійної підготовки вдома, і для короткої перевірки на уроці або консультації.
- Для учня: тренуєш швидкий вибір правильної відповіді та повторюєш ключові поняття з хімії.
- Для батьків: легко контролювати прогрес і бачити, які теми потребують повторення.
- Для вчителів: зручно використовувати як розминку, міні-опитування або домашнє завдання.
Вправа з теми курсів ЗНО з хімії допомагає впевненіше працювати з тестовими формулюваннями та не плутати терміни, які звучать схоже. Регулярно повертайся до таких коротких завдань — і ти швидше запам’ятаєш базові визначення, потрібні для успішної підготовки.
Пов'язані стандарти
Учасник/учасниця ЗНО повинен/повинна вміти:
- записувати та розпізнавати електронні формули атомів і простих йонів елементів № 1—20 і 26 та їхні графічні варіанти, атомів неметалічних елементів малих періодів у основному і збудженому станах. Розрізняти валентність і ступінь окиснення елемента;
- складати формули сполук за ступенями окиснення елементів;
- порівнювати можливі ступені окиснення неметалічних елементів малих періодів, що знаходяться в одній групі, на основі електронної будови їхніх атомів; радіуси атомів і простих йонів;
- аналізувати зміни радіусів атомів у періодах і підгрупах, зв'язоккількості електронів на зовнішньому рівні з характером елемента (металічним, неметалічним), типом простої речовини (метал, неметал), кислотногосновним характером оксидів і гідроксидів, відмінності електронної будови атомів s-,p-, d-eлементів (Ферум) 1-4 періодів;
- визначати склад ядер (кількість протонів і нейтронів у нукліді) і електронних оболонок (енергетичних рівнів та підрівнів) в атомах елементів № 1—20 і 26, загальну кількість електронів і число електронів на зовнішньому енергетичному рівні атомів елементів № 1—20 і 26;
- обчислювати ступінь окиснення елемента у сполуці.